lang geleden ziekte van Alzheimer De ziekte wordt gediagnosticeerd, de eiwitten die ooit onfeilbaar waren, beginnen zich in de hersenen aan elkaar te hechten in een proces dat kan worden versneld door het gebrek aan slaap.
Nu hebben wetenschappers een mogelijk mechanisme ontdekt dat verstoringen in circadiane ritmes en de opbouw van eiwitten geassocieerd met de ziekte van Alzheimer met elkaar verbindt, door het ritmische proces van immuuncellen te bestuderen en de moleculaire “timers” te vinden die ze beheersen.
circadiaanse ritmes Het zijn de circadiane ritmes van lichaamsfuncties die verband houden met de natuurlijke klok van het lichaam, reactie op blootstelling aan licht en controle van slaap-waakcycli.
Slechte slaapgewoonten kunnen het circadiaanse ritme verstoren (veroudering en stress helpen ook niet) en onderbroken slaap Het kan betekenen dat immuuncellen minder tijd hebben om de hersenen te zuiveren van afval dat zich gedurende de dag ophoopt.
Slaapstoornissen die beginnen jaren voordat er symptomen optreden, zijn in verband gebracht met een groter risico van de ziekte van Alzheimer, de meest voorkomende vorm van dementie, en Ernstigere symptomen.
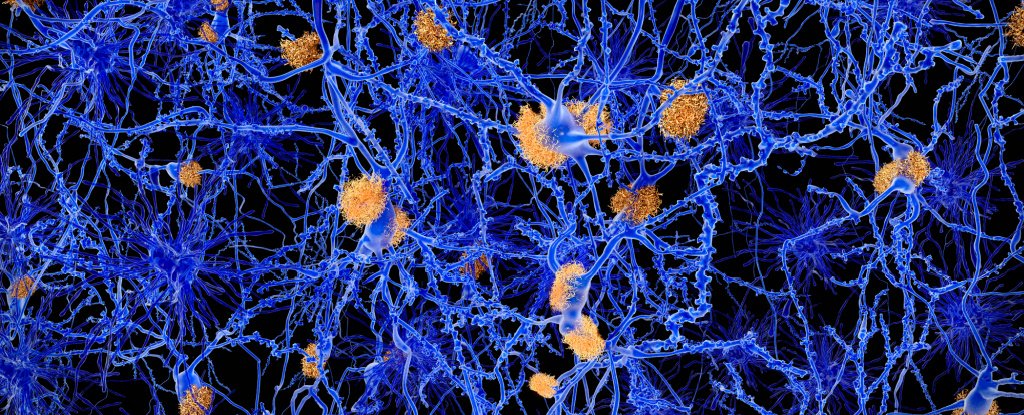
Lange tijd werd aangenomen dat zich na verloop van tijd klonten van misvormde eiwitten – waaronder een eiwit genaamd amyloïde bèta – in de hersenen ophopen om de ziekte van Alzheimer te veroorzaken, een neurologische aandoening die wordt gekenmerkt door geheugenverlies en langzame cognitieve achteruitgang.
dagelijkse schommelingen in amyloïde-bèta-spiegels waargenomen in het cerebrospinale vocht van gezonde volwassenen, maar deze fluctuaties lijken te worden verstoord met de leeftijd, wat de grootste risicofactor is voor de ziekte van Alzheimer.
Een direct verband tussen circadiane ritmes en de activiteit van immuuncellen die zijn belast met het opruimen van amyloïde-eiwitten, is wetenschappers tot nu toe echter ontgaan.
In deze nieuwe studie bestudeerden onderzoekers onder leiding van bioloog Jennifer Hurley van het Rensselaer Polytechnic Institute immuuncellen, macrofagen genaamd, waarvan bekend is dat ze naar de hersenen migreren bij de ziekte van Alzheimer in een laat stadium. Macrofagen zijn uitwerpers die afvalproducten, defecte eiwitten en verouderde cellen opslokken om toxische schade te voorkomen.
In in het laboratorium gekweekte celculturen die onder een microscoop werden waargenomen, begonnen deze immuuncellen – afgeleid van genetisch gemodificeerde muizen met veranderde circadiane klokken – in een dagelijkse cyclus fluorescently-gelabelde amyloïde-bèta-eiwitten op te vangen. Naarmate de niveaus van celoppervlakte-eiwitten, heparan genaamd, stijgen, vertraagt de verwijdering van bèta-amyloïde-eiwitten.
Maar de immuuncellen verloren onmiddellijk hun ritme toen hun circadiane klok verstoord werd, wat suggereert dat heparine op het celoppervlak, de eiwitvoedende immuuncellen, dagelijks onder controle staan.
“Deze gegevens benadrukken dat circadiane regulatie in immuuncellen een rol kan spelen in de complexe relatie tussen de circadiane klok en de ziekte van Alzheimer,” schrijven in hun krant.
Eerder onderzoek heeft aangetoond dat slechts één nacht slecht slapen een toename van bèta-amyloïde eiwitten veroorzaakt, en dat een week zonder slaap ook leidt tot een ophoping van een ander eiwit, tau genaamd. Chronische slaapproblemen kunnen dus problemen veroorzaken.
Het blijft echter onduidelijk of circadiane stoornissen een oorzakelijke factor of een fysiologisch gevolg zijn van de ziekte van Alzheimer.
Houd in gedachten dat deze studie, die tot doel heeft potentiële mechanismen te ontleden die circadiane stoornissen en de ziekte van Alzheimer-eiwitten met elkaar verbinden, immuuncellen gebruikte die uit het beenmerg van genetisch gemodificeerde muizen waren gehaald als een proxy voor wat er bij mensen gebeurt.
“Wat betreft de aard van de circadiane verstoring die optreedt in AD, is er nog veel te begrijpen”, gedrags-neurowetenschapper Andrew Kogan van de Universiteit van Ierland en collega’s boeken In een recensie uit 2013, wat nog steeds waar is.
Het is ook vermeldenswaard dat amyloïde-eiwitten niet het hele verhaal van de ziekte van Alzheimer zijn. De kluwen van tau-eiwitten zijn de andere hoofdverdachten die in beeld zijn gekomen in de nasleep van de frustratie Klinische proeven en toenemend bewijs tegen amyloïde bèta (Aβ) als de belangrijkste boosdoener van de ziekte.
“Hoewel het richten op Aβ als therapeutische strategie beperkt succes heeft gehad, wordt de accumulatie van Aβ nog steeds gezien als een cruciale stap in de pathogenese van de ziekte van Alzheimer”, aldus Hurley en collega’s. ik schrijf.
Ander recent onderzoek suggereert echter dat amyloïde-eiwitten in feite latent zijn in plaats van vroeg veroorzakend, en gebrek aan slaap is niet de enige risicofactor voor de ziekte van Alzheimer.
Het is echter een goede zet om een mogelijk mechanisme te identificeren dat zou kunnen verklaren hoe verstoringen in circadiane ritmes de filtering van amyloïde-eiwitten in de hersenen kunnen verstoren.
Op een omweg ondersteunt dit werk andere onderzoekslijnen die kijken naar zogenaamde temporale therapieën, dit zijn interventies die gericht zijn op De slaapcycli van mensen verbeteren.
Het begrijpen van de circadiane timing van immuuncellen kan implicaties hebben voor andere aandoeningen die verband houden met ontstekingen, zoals de ziekte van Alzheimer, waaronder: Depressie.
“Begrijpen hoe circadiane ritmes de niveaus van heparan aan het celoppervlak kunnen reguleren om de accumulatie van amyloïde-bèta te beheersen, kan leiden tot de ontwikkeling van chronotherapie die de symptomen van de ziekte van Alzheimer en andere ontstekingsziekten verlicht,” Hurley. Zegt.
De studie is gepubliceerd in Genetica PLOS.

“Reizende ninja. Onruststoker. Spekonderzoeker. Expert in extreme alcohol. Verdediger van zombies.”




More Stories
Studie: Reusachtige prehistorische zalmen hadden hoektanden ter verdediging
AHS bevestigt geval van mazelen in Edmonton
Het door ORNL ondersteunde onderzoeksteam gebruikt kwantumcomputers om echte vooruitgang te boeken in de kwantumsimulatie