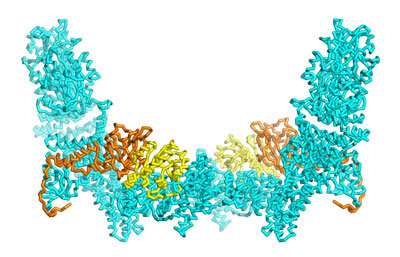
Afbeelding 1: Een nieuwe structurele analyse van het DOCK5-ELMO1-Rac1-complex die nieuwe inzichten biedt in de regulatie van dit kernsignaleringscomplex (cyaan: DOCK5; oranje: ELMO1; geel: Rac1). Credit: © 2021 RIKEN Centrum voor dynamisch onderzoek van biosystemen
De structurele analyse door het All-RIKEN-team biedt gedetailleerde inzichten in hoe DOCK de functie van het cellulaire kinetochoor-proteïnase (DOCK) moduleert en hoe bekende ziektegerelateerde mutaties deze activiteit belemmeren.
Verschillende DOCK-eiwitten spelen een belangrijke rol bij het reguleren van celmotiliteit en rijping, maar worden ook in verband gebracht met tumormetastasen en andere aandoeningen. Hoewel bekend is dat de functie van DOCK gedeeltelijk wordt gecoördineerd door verschillende verzwelgings- en celbewegingseiwitten (ELMO), is het exacte mechanisme van deze regulatie niet goed begrepen.
“We vonden het nodig om de structuur van het hele ELMO-DOCK-eiwitcomplex te analyseren”, zegt Mutsuko Kukimoto-Niino van het RIKEN Center for Dynamical Systems Research.
Om dit te bereiken, gebruikten zij en haar collega’s een techniek genaamd cryo-Elektronen microscoop, die 3D-structuurkaarten van eiwitten kan genereren met een resolutie op atomaire schaal (Fig. 1).
Als model analyseerden ze de structuren waarin ELMO1 en DOCK5 werden geassembleerd tot complexen met behulp van Rac1, een signaaleiwit dat biologische processen initieert die worden gecontroleerd door DOCK5. Dankzij deze experimenten konden ze zich concentreren op een specifiek domein van ELMO1 dat de interactie met DOCK5 bemiddelt, maar dit zorgde er ook voor dat Rac1 in het complex werd opgenomen.
Rac1 is slechts een van de vele signaalmoleculen waarmee verschillende DOCK-eiwitten een interactie kunnen aangaan, en de specificiteit van deze samenwerking is een cruciale bepalende factor voor de cellulaire respons die wordt gegenereerd door DOCK-activiteit. Een reeks mutagenese-experimenten toonde aan dat interacties van ELMO1 met Rac1 nodig zijn om deze specificiteit vast te stellen. Met andere woorden, DOCK5-Rac1-binding was aangetast als gevolg van sequentieveranderingen die dit gebied van ELMO1 verstoorden.
Computermodellering bevestigde dat het DOCK5-ELMO1-complex vrijwel niet in staat was te binden aan Cdc42, eiwit signaal Het is bekend dat het bindt aan andere leden van de DOCK-eiwitfamilie.
“De meest interessante bevinding in deze studie is dat ELMO niet alleen helpt bij het activeren van signaaleiwitten door DOCK, maar ook betrokken is bij hun specifieke herkenning”, zegt Kukimoto-Niino.
De onderzoekers waren ook in staat om ziektegerelateerde mutaties in kaart te brengen op specifieke functionele elementen binnen het complex. Ze traceerden bijvoorbeeld de mutatie die muizen blootstelt aan acuut cataractletsel naar een domein in DOCK5 dat dit typisch aantoont eiwit naar het celmembraan.
In de toekomst wil het team aanvullende structurele snapshots met hoge resolutie van DOCK-eiwitten in verschillende stadia van het signaleringsproces genereren om een betere greep te krijgen op hoe hun activiteit wordt gereguleerd.
Mutsuko Kukimoto-Niino et al, Cryo-EM-structuur van het menselijke ELMO1-DOCK5-Rac1-complex, wetenschappelijke vooruitgang (2021). DOI: 10.1126 / sciadv.abg3147
de Quote: Inzicht in de specificiteit en functie van een essentieel signaaleiwit (2021, 1 november). Opgehaald op 1 november 2021 van https://phys.org/news/2021-11-insights-specificity-function-essential-protein.html
Op dit document rust copyright. Niettegenstaande elke eerlijke handel met het oog op eigen studie of onderzoek, mag geen enkel deel worden gereproduceerd zonder schriftelijke toestemming. De inhoud is uitsluitend bedoeld voor informatieve doeleinden.






More Stories
China is van plan het Tiangong-ruimtestation uit te breiden; Stel deze in op “Space Rule” omdat het ISS wordt uitgeschakeld
De Verenigde Staten detecteren het eerste geval van de H5N1-vogelgriep bij een varken, wat aanleiding geeft tot bezorgdheid voor de mens
NASA zal in 2025 de ruimtewandelingen aan boord van het internationale ruimtestation hervatten na een lek in het ruimtepak